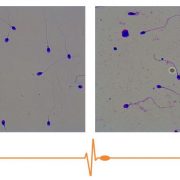
Sistema CASA de análisis espermático
Un sistema CASA de análisis espermático es aquel que tiene como objetivo fundamental realizar un análisis preciso, basado en la repetición y realizado de manera automática, de algunos parámetros que aparecen en una muestra espermática.
Los datos más habituales que se solicitan y ofrecen son: concentración, movilidad, morfología, fragmentación de ADN, vitalidad, reacción del acrosoma y leucocitos.
Aunque hay sistemas que, dependiendo de su complejidad y de las variables que trabajan, ofrecen más o menos resultados en este sentido.
Sistema CASA
Sistema CASA de análisis espermático
En la empresa valenciana Proiser llevan más de 25 años trabajando e investigando en esta área. De hecho, son los responsables del Sistema ISAS (Sistema Integrado de Análisis de Semen) , uno de los más prestigiosos del mercado. De ahí que haya recibido numerosos reconocimientos a nivel internacional donde se refieren a él como un elemento indispensable para trabajar adecuadamente en el sector.
Así, gracias a los equipos de investigación, la empresa Proiser ha logrado formar un equipo compacto de desarrolladores de software y científicos, capaces de interactuar y de compartir la información que el cliente necesita.
La irrupción del sistema ISAS en el mercado fue revolucionaria. No sólo porque era la primera solución de este tipo presentada en el mercado. Sino porque marcó un antes y un después en el entorno del diagnóstico de las muestras de semen.
En la actualidad hay variaciones de este concepto que se pueden adquirir en empresas especializadas, aunque la solución ofrecida por Proiser sigue liderando el mercado dada la gran diferencia existente con la competencia. Y es que seguimos inspirando a quienes se dedican a este sector.
Existen aplicaciones adaptadas a las particularidades de cada animal con el que se trabaja. Así, en Proiser ponemos al alcance de los profesionales sistemas de análisis de semen bovino, porcino, de zorros, caballos o incluso de conejos. De manera que puedas conseguir el mejor de los resultados posible.
Mucho más que análisis espermático
Para que puedas trabajar con los mejores materiales en la empresa valenciana Proiser también tenemos: cámaras de recuento espermático, placas y platinas calefactadas, así como kits de tinción y de reactivos. Además, de poner a tu disposición software para microscopios, sistemas de medición de ovocitos y todo tipo de microscopios. Elementos de gran calidad con los que poder desarrollar trabajos de gran envergadura.
Así pues, si buscas un sistema de análisis espermático que te dé datos fiables sobre la calidad del material que tienes, no lo dudes y hazte con nuestro sistema CASA de análisis. No sólo tendrás datos fiables, sino que podrás realizar tu trabajo con un mínimo de error.
No lo dudes y ponte en contacto con nosotros. Nuestro sistema es líder del mercado y nuestra atención al cliente y servicio de soporte también.

Sistema CASA





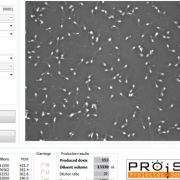
 Para muchos de nosotros tanta información no es necesaria, ya que lo importante es la calidad de las dosis que podemos producir. Para este caso, te ofrecemos los ISASP, son software de análisis para producción. Estos softwares son más específicos para especies como: cerdo, bovino, quinos, zorros y conejos.
Para muchos de nosotros tanta información no es necesaria, ya que lo importante es la calidad de las dosis que podemos producir. Para este caso, te ofrecemos los ISASP, son software de análisis para producción. Estos softwares son más específicos para especies como: cerdo, bovino, quinos, zorros y conejos.